PLACENTA, CORDÓN UMBILICAL Y MEMBRANA AMNIÓTICA EN OFTALMOLOGÍA
MURUBE J, RIVAS L, REBOLLEDA G, CANDELA I, MURUBE I, SALES-SANZ M, GARCÍA PÉREZ J, BARROSO E, CHENZHUO L
Hospital Ramón y Cajal.
Este trabajo ha sido desarrollado con la colaboración de la Fundación de Investigación Médica Mutua Madrileña.
En el desarrollo filogenético de la vida animal, hace unos 220 millones de años surgimos los mamíferos placentarios. Cuando dábamos a luz, tras nuestra cría salía un cordón umbilical, y unida a él, una masa sanguinolenta que hoy llamamos placenta. La criatura despertaba un instinto de atención y cuidados en la madre mayor que en sus predecesores, porque algunas glándulas sudoríparas modificadas, las glándulas mamarias maternas, serían forzosamente las encargadas de suministrarle la nutrición necesaria. No sabemos si el instinto de que las hembras se coman la placenta de su cría surgió simultáneamente o a lo largo del tiempo, pero es el caso que actualmente lo tienen gran número de mamíferos, incluídos los herbívoros (fig. 1). Este fenómeno, conocido como placentofagia instintiva, actualmente perdido en la especie humana, es objeto de especulación científica. Se le han buscado diversas explicaciones, todas ellas hipotéticas: (1) para cortar el cordón umbilical, lo que inconscientemente se extiende a comer la placenta, e incluso ocasionalmente a comerse la cría recién nacida, (2) para no dejar restos que atraigan a insectos, predadores, y otros vivientes potencialmente peligrosos, (3) para mantener limpio el lugar del parto, especialmente si es una cueva, y (4) para no desperdiciar una comida calóricamente nutritiva. Con nuestros conocimientos actuales podemos añadir una quinta hipótesis, la ingestión de un producto cuya importancia no radica en el poder calórico, sino en su contenido en substancias estimulantes y protectoras. Sea cual sea la razón de la placentofagia instintiva, cualquiera de estas posibilidades no excluye a las otras. Lefebvre (192) cree que la placentofagia está inducida por el gen Mest/Pegl, en el cromosoma 7q32.

Fig. 1. Placentofagia. Vaca recién parida comiendo su placenta y membranas fetales.
Placenta significa en latín torta o pastel, y recibió este nombre por el aspecto externo de las bolsa de las aguas al caer al suelo tras su expulsión. Corion es término derivado del griego córion, que significa piel, cuero, y que también se aplicó a todo el conjunto de la bolsa formada por las membranas fetales, aunque hoy, en el lenguaje anatómico científico el término corion sólo se aplica a la membrana fetal externa. Amnion es un término griego, amnion (amnion), diminutivo de amnóV (amnós), que significó cordero y que por extensión, el término amnion también se aplicó en la Grecia clásica a la vasija que servía para recoger la sangre en los sacrificios religiosos, y a la bolsa de las membranas fetales, pero que hoy sólo se aplica a la membrana fetal interna. En español se dijo amnion, pero actualmente es más frecuente expresarlo como amnios, y bien merece la pena dedicar unas líneas al tema de su terminación en «n» o en «s».
La primera vez que se cita este término en castellano lo hace en 1551 el catedrático de la Universidad de Alcalá Andrés Laguna (183,161). En 1766, el diccionario de Terreros (332) lo cita en castellano como amnion, y añade que en francés -la lengua de la cultura en aquella época- se dice amnios. En inglés -la lengua de la transmisión científica tras la segunda guerra mundial- The Oxford English Dictionary lo recoge desde 1667 como amnion, añadiendo que amnios es una forma erróneamente tomada del griego. Hemos consultado el tema con la Profa. M.ª Dolores Jiménez, de la Cátedra de Griego de la Universidad de Alcalá, quien explica que en griego clásico, del substantivo amnoV (amnós, cordero), se derivó el adjetivo amneioV (amneíos), con algunas variantes como amneiós (amneiós) e incluso amnioV (ámnios), que significó «corderil» o «relativo al cordero», y que con el uso el adjetivo ocasionalmente acabó substantivándose, pudiendo significar «cordero». Añade que si la palabra griega nos hubiese llegado a través del latín, diríamos «amnio» (como actualmente se expresa en italiano), pero que como se tomó directamente del griego en la Edad Moderna, amnion es un cultismo correctísimo, mientras que amnios es un galicismo, hoy aceptado por la Real Academia.
Amnion y corion son de origen fetal. El amnion limita por su superficie interna el líquido amniótico en el que flota el feto, y por su superficie externa reviste todo el corion y el cordón umbilical. El corion se adhiere por su superficie interna al amnion, y por su superficie externa a la decidua, que es de origen materno (fig. 2). En el momento del parto, el amnion tiene un espesor medio de 0,2-0,4 mm y el corion de aproximadamente el doble. El amnio-corion que reviste el plato placentario es un poco más grueso. La decidua, es de origen materno, y es la mucosa uterina de la madre, transformada durante la gestación para conectar el útero materno a la superficie externa del corion y del plato placentario.
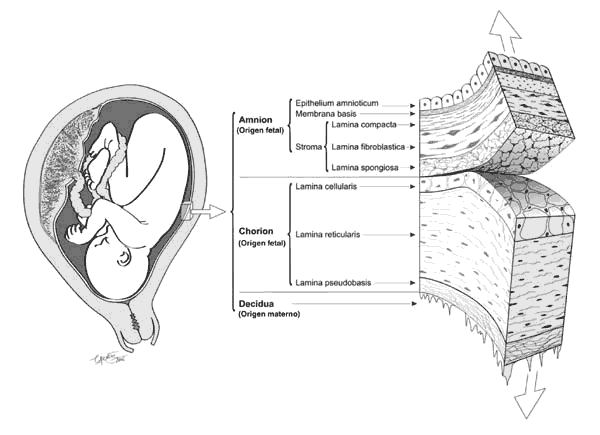
Fig. 2. Membranas fetales humanas al término de una gestación normal.
A. Amnion: tiene 3 capas: 1. Epithelium amnioticum: Capa monocelular de células cuboideas, que contienen muchos gránulos secretorios y vesículas pinocíticas. 2. Membrana basis, formada por una lámina lúcida y una lámina densa. 3. Stroma, subdividido en tres estratos: lámina compacta, lámina fiboblástica y lámina spongiosa. Contiene fibroblastos, colágena y otros componentes acelulares. La lámina compacta es la que da mayor resistencia física al amnion. El Amnion carece de vasos sanguíneos, linfáticos y fibras nerviosas. B. Corion: 1. lámina cellularis. 2. lámina reticularis. 3. membrana pseudobasis. C. Decidua: Es la mucosa uterina, de origen materno, transformada durante la gestación. Tras el parto algunos restos de ella quedan adheridos a la superficie externa del corion.
PRIMEROS USOS DE LAS MEMBRANAS FETALES Y PLACENTA EN MEDICINA
Hasta hace menos de un siglo, la causa más frecuente de muerte por lesiones cutáneas extensas debidas a quemaduras, causticaciones químicas y escaldados fue la hipotensión producida por la pérdida de plasma a través de la superficie dañada. Una destrucción dérmica del 25% del cuerpo de una persona de 70 kilos de peso produce la pérdida de unos 5 litros de plasma al día. Se ensayaron diversos métodos para evitar esta pérdida: untado de las áreas dañadas con manteca o con aceite, covertura con goma latex o con parafina, etc. todo ello con mal resultado. En 1910 Davis (66) sugirió usar amnion placentario para cubrir estas lesiones cutáneas, y 3 años más tarde Stern (325) usó la membrana amniótica para cubrir la superficies cutánea en quemaduras corporales, y Sabella (286), quien trabajaba con Stern, empleó el amnion y la superficie del cordón umbilical en 5 casos de ulceraciones cutáneas extensas, obteniendo buenos resultados.
En las décadas siguientes, la placenta, con o sin membranas fetales, se usó para problemas diferentes, ya como recubrimiento tectónico para hacer una vagina artificial (38,41,42), ya como un estimulante biológico reconstructivo (91).
En la década de 1920, Filatov (fig. 3), tras observar que algunas enfermedades mejoran en mujeres preñadas durante los últimos meses de gestación pensó que la placenta y las membranas fetales contienen estimuladores biogénicos. También dirigió su atención a otros tejidos animales y a algunos extractos vegetales, como los del género Aloe (Aloe vera, etc.). En la década de 1930 usó placenta y cordón umbilical para estimular los tejidos degenerados, lo que utilizó inicialmente en pacientes con retinosis pigmentosa, chorioretinosis myopica y degeneracion retiniana macular, y después lo extendió a queratitis herpética, dermatosis, síndrome de Alzheimer, y muchas otras enfermedades. Tras la segunda guerra mundial los escritos e ideas de Filatov (92,93) atravesaron el telón de acero político-militar y penetraron en los hiperosmóticos países occidentales, donde su uso se extendió (71,117,241,19, 69). Algunos autores especificaron la importancia de incluir el amnion de la placenta (71). El optimismo inicial se hizo muy controvertido en los años siguientes, y prácticamente la tisuoterapia feto-placentaria dejó de usarse en los países de occidente, pero persistió en la URSS y países satélites (282,282,155), donde con diversas variantes (amnio-corion, amnion, placenta con o sin membranas fetales) persistió como estimulante tisular o como cobertura mecánica (26). Curiosamente, el origen del big bang del presente uso de la membrana amniótica en oftalmología apareció hace tan sólo 10 años, y no por su uso en quemaduras cutáneas y en cirugía ginecológica, sino por una conexión directa de Rusia a HispanoAmérica y después a NorteAmérica (fig. 4).

Fig. 3. Vladimir Petrovich Filatov (1875-1956).
Se graduó como médico en la Universidad de Moscú en 1897. En 1936 fundó en Odessa (Ucrania, antigua URSS) el Instituto de Enfermedades Oculares y Terapia Tisular. Sus principales trabajos se refirieron a tisuoterapia estimuladora con tejidos animales y vegetales, y a transplantes corneales.

Fig. 4. Placentoterapia. 1. Incisión de la conjunctiva y cápsula de Tenon en el cuadrante infero-lateral, a 10-12 mm del limbo. 2. Introducción de una pieza de placenta del tamaño de un guisante (tomado de Arruga (10)).
Entretanto, durante el medio siglo transcurrido entre la segunda Guerra mundial y 1995, las membranes fetales se usaron en el mundo occidental más como una cobertura tectónica que como un estimulante biogénico, aunque a veces con la sospecha de que la cobertura o reconstrucción física se complementaba con algunas propiedades biológicas aditivas. En oftalmología, los primeros tejidos que se habían usado para reconstruir la conjuntiva de la superficie ocular fueron diversas membranas orgánicas, tales como la misma conjuntiva (32), mucosa oral (68), prepucio y labios menores de la vulva (58), mucosa vaginal (324) y peritoneo (39), pero su uso no se extendió debido a sus pobres resultados. Muchos años más tarde aparecieron reconstrucciones conjuntivales con otras membranas orgánicas, como pericardio (323,293) y pleura (252).
El primer uso de membranas fetales en oftalmología se publicó en 1940 por de Rötth (68), quien usó membrana fetal de espesor total (amnion corion) para reparar 8 casos de simbléfaron (7 por quemadura y 1 por pénfigo), y para agrandar y mantener el hueco orbitario en 2 casos. En los casos de simbléfaron hacía una perilimbotomía, y después cubría la córnea, la esclera y la superficie posterior de los párpados con membrana fetal total y la suturaba a los tendones musculares para reformar la superficie ocular y los fórnices. Ocasionalmente añadía una lente de contacto de cristal, que mantenía una semana. Obtuvo malos resultados por la retracción del implante, salvo en un caso que consideró un éxito. Puede ser, aunque no lo dejó claramente expresado, que De Rötth no solo pensó en una acción tectónica de cobertura sino que sospechó una estimulación biológica, pues en uno de sus casos de reconstrucción de la cavidad orbitaria intentó obtener la reepitelización de esta cavidad rellenándola con vernix caseosa, la capa sebácea que recubre la piel del feto.
En 1941, Brown (39) intentó reconstruir la superficie orbitaria con otras membranas animales, como peritoneo de conejo, pero fueron Sorsby et al (317,318) quienes volvieron a usar membrana amniótica en 1946 y 1947. Estos autores trataron con cobertura de membrana amniótica 58 casos de causticaciones oculares, 43 de ellas debidas a quemadura por cal, y el resto por otros cáusticos, pero sólo lo aplicaron para reparar la conjuntiva y evitar o reparar la retracción fornicial y simbléfaron. Utilizaban varias capas de amnion y suturaban la pieza resultante a la conjuntiva vecina. A las 4 horas el injerto se hacía transparente, y al tercer o cuarto día hacían la rafectomía o eliminación de suturas. No consideraban conveniente cubrir la superficie corneal porque pensaban que podía perjudicar la córnea y aumentar su nebulosidad (317), cosa ésta que no les ocurrió en todos los casos. Sorsby et al no escribieron apenas sobre el mecanismo de acción biológico, expresaron que la membrana amniótica no estimula el crecimiento, sino que actúa como un entablillado interno para la proliferación del tejido (318) y que aunque la separación mecánica de las superficies causticadas juega un papel, el rápido efecto del amnion sugería un efecto biológico que era más importante que el mecánico (317).
El mismo año 1946, Lavery (185) publicó otra aplicación reconstructiva de la superficie en un paciente que tuvo una salpicadura de cal en un ojo. Fue tratado con irrigación y atropina tópicas, y con una banda de «amnioplastina» que se le colocó 4 días después. A las 3 semanas la opacificación de la córnea se redujo marcadamente.
Diecinueve años después, en la discusión de una presentación de Roper-Hall (283), Sikka (308) manifestó que durante los dos últimos años había hecho implantes de membrana amniótica en pacientes con quemaduras de la superficie ocular, para prevenir la adhesión de estas superficies. Este cirujano adhería la membrana amniótica a un anillo de Flieringa el cual lo introducía en la cuenca lacrimal, de forma que el anillo quedaba expandiendo los fórnices conjuntivales y la membrana cubriendo toda la superficie. No tapaba el ojo durante los 3-4 días en que mantenía el anillo.
En 1985 Steinkogler et al (323) usaron membrana amniótica liofilizada para reconstruir defectos conjuntivales en conejos.
Tras la segunda Guerra Mundial, el inglés pasó a ser la lengua de la difusión científica, pero no se volvieron a hacer más publicaciones oftalmológicas en esta lengua hasta 30 años después, de manera que la reconstrucción física de la superficie ocular permaneció prácticamente desconocida para los oftalmólogos. Bruscamente, en 1995 se inició la gran explosión del uso de membrana amniótica en oftalmología. ¿Cómo ocurrió? ¿qué pasó para hoy cada año se publiquen más trabajos sobre membrana amniótica en oftalmología que en todas las otras especialidades médicas juntas?
Las cosas pasaron así. En 1989, Horacio Serrano, un oftalmólogo español nacionalizado en Venezuela, presidente de la Sociedad Venezolana de Oftalmología, visitó durante dos semanas la clínica del Dr. Ernst Muldasev, en Ufa (República de Bashkirskaia. 56º E, 55º N). Muldasev (228) era conocido por sus transplantes de tejidos orgánicos. Serrano pudo observar los pobres resultados que sus transplantes daban en pacientes con retinitis pigmentosa, pero los sorprendentes buenos efectos en los casos de reconstrucción de la superficie ocular. El tejido que Muldasev aplicaba lo denominaba «tejido conjuntival», pero rehusaba explicar qué clase de tejido conjuntivo era, aduciendo razones de patente. Serrano compró varias unidades, y en seguida de retornar a Venezuela las aplicó en el hospital Francisco Rísquez, de Caracas, cubriendo la superficie ocular en casos de pterygion, quemaduras por álcalis y simbléfaron, con resultados extraordinarios. Serrano y su discípulo Carlino González (297,298,115) dieron algunas conferencias en la República Dominicana, donde operaron varios casos con el Dr. Juan Batlle. Tras algunos análisis histológicos, descubrieron que el «tejido conjuntival» de Muldasev era membrana amniótica (23). Desde entonces, ellos prepararon sus propias membranas amnióticas conservándolas en alcohol absoluto. En 1992, Juan Batlle traspasó este conocimiento a Scheffer Tseng (24,188,232,78) quien trabajaba el Hospital Bascom Palmer (Miami FL), y en 1993 lo publicó (25). Tseng (fig. 5) inició la época actual de la membrana amniótica en oftalmología. Su interés, capacidad, habilidad y efectividad en la impulsión de equipos de trabajo atrajo la atención de los oftalmólogos e investigadores relacionados, y desde 1995 sus continuas investigaciones y publicaciones (162,163,349,351, 261-263,371,188,264,214,215,351,352,257,216, 217,353,251,49,40,218-220,258,354-356,313-315,6,7,22,140,57,221,357,358,127,128,340, 129,211,82,315,359,139) sacaron nuevos resultados en el tratamiento de la superficie ocular, y estimularon nuevos estudios en otras áreas de la oftalmología.

Fig. 5. El Dr. Scheffer Tseng con dos de los autores de este artículo, tras operar un paciente con queratomalacia mediante cobertura con membrana amniótica, en el verano de 1997, en el Hospital Ramón y Cajal, de Madrid.
USOS NO OFTALMOLÓGICOS DE LA MEMBRANA AMNIÓTICA HASTA 1995
Simultáneamente al escaso número de publicaciones sobre el uso de membrana amniótica en oftalmología, aparecieron algunas sobre sus usos en otras especialidades clínicas. El uso más frecuente hasta 1995 se dio en dermatología para proteger y curar las quemaduras, úlceras y heridas cutáneas (66,325,286,256,179, 346,255,60,369,34,30,86,269,2,266,307,373, 299,265,134,226,11,291,329,143,327,109). Ocasionalmente, estas lesiones cutáneas también se trataron con corion (73).
Otros usos se publicaron en oto-rino-laringología, para reconstrucciones de oreja (44), timpanoplastia en perforaciones (385) y en substitución de mucosa nasal (385,184). En ginecología, para tratar malformaciones congénitas, traumáticas u oncológicas de la vagina (38,41,42,210, 342,341,330,209,63,16,242,337,243,9), o para cubrir mastectomías (131). En estomatología, para reformar la cavidad bucal tras ablaciones de la mejilla (186), glosectomía total (175) o defectos vestibulares (133). En digestivo, para reconstruir la pared abdominal (309), reparar onfaloceles (111,336), cerrar fístulas entero-cutáneas (179), gastrosquisis (272), parcheos intestinales (18), substitución de peritoneo (342-344,112), prevención de adhesión a otros tejidos (345,15) y esplenorrafia experimental (81). En urología, para reconstruir la vejiga urinaria (245,94). En cardiología, para cierres pericárdicos (229). En neurología, para prevenir adhesiones meningo-cerebrales en accidente craneales (48), reparaciones de dura mater (42,48,269) o utilizándola como matriz para reinervaciones (67,65,43). En endocrinología, para crear una cámara de difusión para islotes de Langerhans en pacientes diabéticos (204) y en metabolopatías (5,2,292). Y en artrología, para artoplastias de la cadera (368).
USOS DE LA MEMBRANA AMNIÓTICA EN OFTALMOLOGÍA DESDE 1995
La reconstrucción conjuntival fue uno de los primeros y más importantes usos de membrana amniótica en casos de causticaciones, síndromes de Stevens-Johnson, penfigoides, extirpaciones conjuntivales tras melanosis, neoplasia, etc. (360,349,261,301,351,176,232,215,351,54, 180,51,362,114,104,288,75,219,220,77,295, 212,165,321,280,159,225,173,384,250,300, 157,27,72,296,365,315,253,35,146,160).
Para reconstrucción corneal, la membrana amniótica se usó primero experimentalmente (162,163), y después experimental y terapéuticamente en quemaduras, úlceras, perforaciones, queratomalacia, queratocono, etc. (360, 361, 214, 237, 164, 177, 14, 120, 363, 267, 257, 258,49, 52, 178, 165, 355, 220, 136, 103, 193, 79,173,174, 326, 322, 225, 300, 7, 166, 213, 365,121,122,169, 238-240, 17, 95, 211, 53, 33, 160,377,198) (fig. 6).

Fig. 6. A: Córnea que ha desarrollado una queratomalacia (corneal melting) tras un proceso autoinmune con opacificación, vascularización y ulceración. No hay perforación corneal, pues persiste la membrana de Descemet. B: Se rellenó el área ulcerada con 4 capas de membrana amniótica y su cubrió todo ello y el resto de la córnea con una monocapa de membrana amniótica con el epitelio hacia arriba. C: Se hizo una perilimbotomía conjuntival. Se cortó toda la membrana amniótica que sobrepasaba el limbo sobre la conjuntiva y sus bordes se introdujeron bajo la conjuntiva de la perilimbotomía. Finalmente se suturó en toda la circunferencia la membrana amniótica a la conjuntiva. D: Tres meses después, la queratomalacia había desaparecido, aunque persistieron la opacidad y vascularización corneal. Hay conjuntivalización corneal.
La expansión limbal sobre membrana amniótica fue introducida por Tsubota et al (360,361) y Tseng et al (350) como substrato para cultivar células estaminales limbales del epitelio corneal, o como substrato para auto- o alotransplantes en casos de quemaduras, síndromes de Stevens-Johnson, aniridia, penfigoides (262,351,302, 289,13,214,215,233,50,217,120,138,216,76, 149,347,273,258,6,12,171-174,357,334,221, 303,127,128,340,148,238-240,129,130,82,74, 211,335,253,83,359,276,196,197,139).
Otros usos oftalmológicos han sido en queratoplastias para cubrir la córnea y la conjuntiva bulbar (224), en cirugía refractiva, tras PRK y LASIK para reducir la inflamación, la nebulosidad corneal, y para facilitar la cicatrización (371, 372, 56,251,376), en pterygion (297, 261, 263, 302,1 04, 200, 190, 314, 224,304, 253, 35), en conjuntivochalasis (219,108,235), en aniridia (351,193,1221, 148,276), en perforación escleral (278,136), en glaucoma (fig. 7), para reparar o mantener las ampollas filtrantes antiglaucomatosas, así como para reparar la superficie ocular en tubos de drenaje expuestos (20, 21, 232, 100, 288, 22,258,40, 384,4), en cirugía palpebral para simbléfaron y entropion, mejorando los fórnices conjuntivales (349, 232, 31, 302, 178, 333), en oculoplástica (fig. 8) para rellenar subcutáneamente el surco orbito-palpebral en personas con él muy profundo (231), y en ojo seco, para parchear los puntos lacrimales en lugar de usar tapones plásticos (232,230,234,78) y para tratar temporalmente lesiones de keratoconjunctivitis sicca (320).

Fig. 7. Glaucoma crónico simple que había sido tratado con trabeculectomía y mitomicina C, con buen resultado inmediato. Dos años después, la esclera se fistulizó espontáneamente, bajando la presión intraocular a 0-3 mmHg y apareciendo un edema macular. A: Se levantó la conjuntiva, se eliminó el iris herniado (B), y se cubrió el área expuesta con una capa doble de membrana amniótica (C), sobre la que se repuso la conjuntiva. D: La ampolla filtrante se reformó, manteniéndose presiones intraoculares entre 9 y 14 mmHg.

Fig. 8. A: Surcos órbito-palpebrales superiores profundos. Marcado con lápiz dermográfico del lugar de apertura de la piel y subcutáneo. B: Relleno del área abierta con varias piezas de membrana amniótica de 3x3 cm plegada sobre sí misma. C: Sutura de las piezas e membrana amniótica en el lugar deseado. D: Aspecto meses después.
CARACTERÍSTICAS BIOLÓGICAS DEL AMNION
Simultáneamente a estas aplicaciones clínicas, ha habido una abundante investigación básica sobre anatomía (64,37,367) microscopía electrónica (260,78), citoesqueleto de las células epiteliales (247), filamentos intermediarios (28), fibronectina de la matriz extracelular (195), integrinas (316,203,36), histología de la membrana basal (381,45,78), tipos de colágena (222,223,8), etc. El amnion sirve como membrana semipermeable para estudiar el flujo de Mg en laboratorio (8), y para formar bolsas que contengan islotes de Langerhans (204,84) que permitan su transplante (110). La fuerza tensil de la membrana amniótica es muy alta, debido a su contenido en colágena (205), llegando a entre 0,05 y 0,45 kg/cm (259) y alcanzando presiones de ruptura de 393 a 900 mmHg (202).
La antigenicidad del amnion es escasa, y por ello no desencadena reyección inmunológica. El epitelio de la membrana amniótica expresa escasamente antígenos HLA y DR, o beta2-microglobulinas (73,116,85,5,2,375,150,135,181). El citoesqueleto y la matriz estromal también muestran una escasa antigenicidad (375). La antigenicidad de la córnea y del amnion tienen bastante similitud (59,294) y el epitelio limbal no reacciona contra la membrana amniótica (152). Esta escasa antigenicidad también es característica del amnion de otros animales, como los bóvidos (269), pero es preferible usar membranas amnióticas humanas porque son más fáciles de obtener en los hospitales mediante cesáreas programadas. En contraste con el amnion, el corion es bastante antigénico y provoca un fuerte rechazo en los transplantes alogénicos (73).
Los altos niveles de muchos factores de crecimiento y de mediadores mitogénicos de la membrane amniótica promueven la epitelización de la superficie corneal (151,270,152,328,147,375, 306,3,301,290,353,374,189,190,359,170,190, 178,311,57,27,378,340,359,139,191). Por el contrario, la membrana amniótica inhibe la neovascularización corneal y conjuntival (46,162,163,3,137,169,201,144).
Se ha estudiado la producción y acción del amnion en leucotrienos (271), prostaglandinas (158,113,284,312), interleukinas (284,90,282, 306,249,161,154,313), enzimas (29,2,254,118, 338,339,62,227,164,237,153,274), y su contenido vitamínico (246).
La acción antiinflamatoria del amnion ha sido reiteradamente evidenciada (60,343,237,137, 305,281). No obstante, se ha publicado un caso en el que repetidos recubrimientos corneales con membrana amniótica del mismo donante provocó hipopión que fue curado con corticosteroides (103), sugiriendo el autor el uso de diferentes donantes cuando haya que aplicar varios transplantes.
La cicatrización bajo el transplante de membrana amniótica es bien controlada, reduciéndose la proliferación fibroblástica, y la cicatriz exuberante (60,343,188,301,379). Se ha comprobado en conejos que la membrana amniótica reduce la nebulosidad tras keratectomía fototerapéutica (371,372).
La migración del epitelio corneal y conjuntival sobre la membrana amniótica es fácil (163,301, 188,380,47,101,172,221,238), siendo usada como anteriormente se citó, para inducir la expansión de células limbales estaminales. El amnion también se ha usado como substrato para cultivar y expandir diversos tipos de células, como pneumocitos (199), keratocitos (83) endotelio vascular (192) o células epiteliales de diversos tipos, como dérmicas, traqueales y bucales (60,343,331,244). La unión de estas células epiteliales a la membrana amniótica es firme (316), posiblemente por la similitud composicional en colágena tipo V de la membrana basal de estas células y de la membrana amniótica (222). El epitelio que migra y se extiende sobre la membrana basal amniótica mantiene sus caracteres diferenciales propios (182). La posibilidad de una transdiferenciación epitelial (es decir, la transmutación de las características propias del epitelio transplantado por las de otro epitelio), que se sospechó hace unos años, no ocurre (182,262,55).
Una acción antibacteriana no específica ha sido confirmada (132,370,106,268,277,343,329, 249,153,98,104,167,168,166) así como una cierta acción antiviral (88,89,141,142). La membrana contiene péptidos interferón, con propiedades antiviral, inmunomoduladora y antiproliferativa (88, 89,329,98,167).
CÓMO PREPARAR LA MEMBRANA AMNIÓTICA PARA SU IMPLANTACIÓN
Las técnicas de preparación y conservación de membrana amniótica para su implantación quirúrgica han variado ampliamente (99). La primera preparación de membrana amniótica para uso dermatológico fue hecha en 1913 por Sabella (286), quien separaba el amnion del corion, y mantenía la vitalidad del amnion en solución salina fisiológica durante 72 horas, usándola para tratar quemaduras y heridas cutáneas. La primera preparación para uso oftalmológico la publicó De Rötth en 1940 (68). Este autor tomó las membranas fetales de espesor total (amnion más corion) de mujeres Wassermann negativas que daban a luz por cesárea, y las conservó en en solución Locke templada durante 1 a 15 horas, hasta usarla en pacientes para reconstruir su superficie ocular. Durante la segunda Guerra mundial, Chao (48), aisló membrana amniótica, la sumergió en alcohol al 70%, la secó al calor de una estufa, y finalmente la almacenó en alcohol al 70%, usándola más tarde para cirugía craneal. A esta membrana así preparada la denominó «amnioplastina». Unos años después, el London Hospital preparó «amnioplastina» con un método diferente (185,317-319): la membrana amniótica era separada de la coriónica, lavada al agua corriente y sumergida en una solución saturada de sal común durante 12 horas. Después era lavada en agua destilada durante 10 a 30 minutos, y sumergida en solución de hidróxido potásico al 0,75% durante al menos 30 min hasta que la membrana quedase libre de álcali. Después era sumergida en agua destilada durante 12 horas. Finalmente la membrana era extendida sobre un marco de madera, secada a temperatura doméstica, esterilizada por calor seco a 150ºC durante una hora, y almacenada estéril en una envuelta de celofán, plegada en cuatro capas de 25x25 mm cada una.
La siguiente preparación que se conoce para uso oftalmológico es la de Muldasev en la década de los 1980, quien conservaba la membrana amniótica en una vial con etil-alcohol (297,298,78).
En la década siguiente, desde 1993-5, las primeras preparaciones del equipo de Tseng en Miami (162,163,188) tomaban la placenta y membranas fetales de partos por cesárea de madres que eran seronegativas para sífilis, SIDA, y hepatitis B y C. Inmediatamente, la introducían en una bolsa estéril y la transportaban al laboratorio, donde en condiciones de asepsia, preferentemente en una cámara de corriente lamelar estéril, la limpiaban de coágulos, vernix caseosa, meconio y cualquier otro resto fetal, hasta dejarla macroscópicamente limpia, usando para ello una solución salina conteniendo penicilina (50 µg/ml), estreptomicina (50 µg/ml), neomicina (100 µg/ml), y amfotericina B (2,5 µg/ml) (349), -otros autores usaron simplemente solución salina (343) o BSS con diversos antibióticos (51)-. El amnion es separado del corion por simple tracción manual en direcciones opuestas (fig. 9), lo que resulta fácil debido al espacio virtual que existe entre ambas membranas. El corion se desecha, y el amnion se extiende y aplana sobre una hoja de papel de filtro de nitroceluosa dejando su superficie epitelial hacia arriba y la matriz estromal, pegajosa e irregular, en contacto con el papel. El papel de filtro con el amnion adherido se corta en cuadrados o en discos de aproximadamente 3-4 mm de anchura, y cada fragmento se introduce en un vial conteniendo glicerol al 100% a 4ºC durante 1 semana. Este preservante se cambió poco después por una solución a partes iguales de glicerol y medio de Dulbecco-Eagle, y la temperatura de almacenamiento se cambió a -80ºC.

Fig. 9. A: Bolsa fetal, formada por la placenta, membranas fetales (amnion y corion) y cordón umbilical. B: Separación manual del amnion y el corion, empezando por la zona de ruptura espontánea de la membrana y continuando por la zona placental.
La crio-conservación a -80ºC tiene la particularidad de que a esta temperatura la actividad mitocondrial es prácticamente nula. Se han usado diversas soluciones conservantes. Shimazaki et al (301) lavaban la membrana fetal completa con solución salina fisiológica complementada con antibióticos, separaban después el amnion, lo cortaban en piezas de 3x3 cm, que finalmente introducían en frasquitos de plástico que contienen dimetil sulfóxido, que después mantienen hasta su uso a -80ºC. Adds (1) introduce las piezas de membrana amniótica en una solución al 50% de glicerol/solución salina balanceada de Hank, que conserva después a -80ºC. Nosotros (234) hemos usado frecuentemente como medio de almacenaje K-Sol, DexSol u Optisol, habitualmente usados para córneas para transplante, y los hemos conservado a -80ºC.
La membrana amniótica humana tras estar un mes a -80ºC mantiene altos niveles de diversos factores de crecimiento (188,301,262,170).
La crio-conservacion a -20ºC es usada por muchos cirujanos porque es la temperatura de los congeladores de los frigoríficos comerciales más accesibles. A esta temperatura las células mantienen su vitalidad menos tiempo que a -80ºC porque la actividad de los enzimas mitocondriales no queda completamente bloqueada, y se desarrolla una progresiva destrucción enzimática de la membrana. Muchos cirujanos sólo utilizan esta membrana durante el primer mes de conservación porque durante él su acción bioquímica y su fuerza tectónica se mantienen casi intactos. Así, Kruse (178) puso membrana amniótica en un medio a partes iguales de glicerol y de Dulbecco-Eagle, y la crio-preservó a -20ºC, o en nitrógeno líquido (cuyas temperaturas suelen ser mucho más bajas, de hasta -195ºC), observando que las células de la membrana se desvitalizaban. La desvitalización a -20ºC, según algunos autores (380,178), hace que cuando la membrana se aplica a la superficie ocular como substrato de expansión para el epitelio limbal, éste se extienda rápidamente sobre la membrana amniótica.
La crio-conservación a 4ºC se utilizó por primera vez, a nuestro saber, por Dino et al (70) en 1966, para conservar membrana en un Banco de Amnion para uso en cirugía general. Estos autores introducían el amnion en solución salina isotónica a la que añadían un 0,25% de hipoclorito sódico y 200.000 unidades de penicilina, y la almacenaban a 4ºC. Este método se extendió bastante, pero no se usó en oftalmología. Se elige la temperatura de 4ºC, porque es a la que el H2O tiene su mínimo volumen (y por consiguiente su máximo peso en relación con un volumen dado. Ésta es la razón de que el hielo flote sobre el agua), y no altera apreciablemente la estructura histológica. Según algunos autores la membrana así conservada puede desencadenar mayor rechazo inmunológico debido a una mayor expresión antiigénica de la matrix.
La crio-conservación a 4ºC mantiene la vitalidad de las células epiteliales durante varios días, con un máximo de un mes (97), dependiendo este tiempo del medio de almacenamiento usado. Hoy día el líquido de conservación más usado es el de Dulbecco-Eagle con glicerol, a partes iguales, pero hay cirujanos que prefieren solución salina isotónica adicinada con polimixina, ampicilina, gentamicina y anfotericina B (343), solución de glicerol (206), o solución CPTES conteniendo 2,5% de condroitín sulfato (1) a 4ºC.
La conservación a temperatura doméstica (²23±7ºC) era la utilizada para la «amnioplastina» de Chao (48), Sorsby (317-319) y Lavery (185) y para el «alotransplante conjuntival» de Muldasev (297,298), y su forma de preparación cambia según los distintos gestores. Rao et al (269) tomaban el amnion de la superficie placentaria a corta distancia de donde emerge el cordón umbilical. Lo limpiaban con solución salina conteniendo algo de hipoclorito cálcico, lo extendían sobre una lámina de plástico y lo secaban al aire ambiente. Después lo introducían en una bolsita de politeno, cuya abertura sellaban a continuación. Las bolsitas eran esterilizadas con luz ultravioleta o con rayos gamma. La liofilización de las membranas (44,323,224) y la esterilización por radiación (269,364,207,224) se usan desde hace bastantes años para cirugías no oftalmológicas, y sólo raramente en oftalmología. Las membranas amnióticas comerciales son algo difíciles de distribuir congeladas, y por ello generalmente se preparan para mantenerse a temperatura ambiental normal, ya inmersas en alcohol etílico, ya deshidratas por liofilización. La experiencia ha mostrado que mantienen una buena capacidad física tectónica y muchas de sus propiedades biológicas.
Otras preparaciones de amnion son los extractos de membrana amniótica y el líquido amniótico. El extracto de membrana amniótica fresca mantiene una actividad enzimática alta. Se ha usado en forma de suspension homogeneizada de membrana amniótica conservada a -80ºC, aplicándola en pacientes con úlceras corneales neurotróficas, úlceras corneales tórpidas de más de 4 meses de duración, quemaduras corneales, queratotransplantes, y síndromes de Sjögren con manifestaciones clínicas graves, usándola a dosis de 2 gotas, sex in die, durante 2-4 semanas. A los 15-20 días de uso, las córneas suelen mejorar y hacerse fluoresceín-negativas (96, 292,237).
El líquido o fluido amniótico se ha usado también en enfermedades de la superficie ocular. Durante el embarazo el líquido de la bolsa de las aguas circula continuamente, con una renovación (turnover time) que al final del embarazo es de 14 1/2 horas (156). Cuando se usa tópicamente en colirio reduce la neovascularización corneal (144), estimula la re-epitelización (145) en ratones, y aumenta la regeneración nerviosa en las keratectomías con láser (187,287). También es bacteriostático (104,370).
Transmisión de enfermedades. Se ha documentado ocasionalmente la transmisión de enfermedades padecidas por la madre donante de la membrana amniótica (310). La serología materna debe analizarse antes del parto, especialmente para las enfermedades maternas transmisibles más frecuentes o peligrosas, como sífilis, SIDA y hepatitis A y B. Además, el parto es aconsejable que sea por cesárea para minimizar la posibilidad de infección de la bolsa de las aguas en un parto transvaginal.
Han sido muchos los transplantes de membrana amniótica de madres seronegativas que se han efectuado inmediatamente tras el parto con membranas no conservadas (26,107,248,212, 213,365). Sin embargo, existe la posibilidad de que alguna de estas madres sea seronegativa en el momento del parto, pero pueda haberse infectado algunas semanas antes y aún no sea analíticamente seropositiva pese a padecer ya una enfermedad transmisible. Por ello, debe conservarse la membrana por cualquiera de los métodos descritos durante 3-6 meses después, preferiblemente 6 (1); después, repetir la serología de la madre, y si sigue siendo negativa, efectuar entonces el transplante de la membrana. Por ello en consentimiento informado de la madre donante debe incluir que, si no cambia de opinión, deberá repetir el análisis de sangre unos meses después (87).
La actividad biológica del epitelio de la membrana preservada depende del método de conservación utilizado. El epitelio amniótico es el principal productor de líquido amniótico (367,135) y de la mayoría de los factores con acción biológica de la membrana, tales como estimuladores neurotróficos (366), mediadores de apoptosis (285), reguladores de prostaglandinas (284,161) factores de crecimiento varios (170,287,366), endotelina-1 y leukotrienos (46,271), enzimas (2,62,227), moléculas de adhesión intercelular (8,208) e inhibidores de las respuestas inmunes innata y adaptativa (194).
El epitelio de la membrana amniótica preservada, ya sea por crio-conservación a 80ºC (188, 178,78,1) ya por otro método, se considera que modifica y pierde las características biológicasdel epitelio normal y se hace no viable. Sin embargo, esta falta de viabilidad del epitelio no es esencial para su efectividad biológica (78) y de acuerdo a algunos autores, cuando la membrana amniótica ha sido denudada de sus células epiteliales, el epitelio corneal del receptor se extiende mejor sobre la membrana transplantada que cuando el epitelio amniótico aún persiste, como ha demostrado Koizumi (172) en el conejo.
Este artículo termina con la figura 10, que muestra el estado del epitelio amniótico, determinado por citología de impresión, después de la conservación a -80ºC. En un trasplante amniótico sobre la superficie ocular, suponemos que se suman tres causas para la pérdida de la capacidad mitótica e inviabilidad del epitelio: 1, una muerte celular apoptótica genéticamente programada hacia la fecha del parto para un epitelio cuyas funciones se terminan en esas fechas; 2, el daño inducido por el método de conservación, y 3, el ambiente agresivo de la cuenca lacrimal, que lo somete a un daño físico y a una película lacrimal impropia para el endotelio amniótico.

A. Membrana introducida en glicerina y medio de Dulbecco-Eagle al 50/50% y mantenida congelada a -80ºC (método de Lee-Tseng 188) durante dos años. Tras los dos años la membrana fue descongelada, y el mismo día hecha la citología de impresión de esta imagen.
B. Después, la membrana volvió a ser introducida en un nuevo medio de glicerol/Dulbecco-Eagle que se mantuvo a temperatura habitacional, y que se revocó cada 7 días, durante dos meses. Esta imagen muestra la citología de impresión a los 7 días de la descongelación.
C. 14 días tras la descongelación.
D. 30 días tras la descongelación.
E. 45 días tras la descongelación.
F. 60 días tras la descongelación.
Un nuevo uso del cordón umbilical es el de reservorio de células madres del feto para su posible uso en medicina regenerativa. La más reciente información sobre ello puede recogerse en Martínez Urionabarrenetxea K. Ética y bancos de cordón umbilical. JANO, 16-22 junio 2006; 1613: 76-78.
Mas información:http://www.mundialsigloxxi.com/Placenta_y_membrana_amniotica_en_oftalmologia.pdf
http://www.mundialsigloxxi.com/Cobertura_temporal_con_membrana_amniotica_radio_esterilizada.pdf
--------------------------------------------------------------------------------
BIBLIOGRAFÍA
--------------------------------------------------------------------------------
Adds PJ, Hunt CJ, Dart JKG. Amniotic membrane grafts, «fresh» or frozen? A clinical and in vitro comparison. Br J Ophthalmol 2001; 85: 905-907.
Adinolfi M, Akle CA, McColl I, et al. Expression of HLA antigens, b2-microglobulin and enzymes by human amniotic epithelial cells. Nature 1982; 295: 325-327.
Ahmed A, Li XF, Dunk C, et al. Colocalisation of vascular endothelial growth factor and its Flt-1 receptor in human placenta. Growth factors 1995; 12: 235-243.
Ainsworth G, Rotchford A, Dua HS, King AJ. A novel use of amniotic membrane in the management of tube exposure following glaucoma tube shunt surgery. Br J Ophthalmol 2006; 90: 417-419.
Akle CA, Adinolfi M, Welsh KI, et al. Immunogenicity of human amniotic epithelial cells after transplantation into volunteers. Lancet 1981; 1003-1005.
Anderson DF, Ellies P, Pires RTF, et al . Amniotic membrane transplantation for partial limbal stem cell deficiency : long term outcomes. Br J Ophthalmol 2001; 85: 567-575.
Anderson DF, Prabhasawat P, Alfonso E, Tseng SC. Amniotic membrane transplantation after the primary surgical management of band keratopathy. Cornea; 2001; 20: 354-361.
Applin JD, Campbell S, Allen TD. The extracellular matrix of human amniotic epithelium: ultrastructure, composition and deposition. J Cell Sci 1985; 79: 119-136.
Arora M, Jaroidi KA, Hamilton CJ, Dayel F. Controlled comparison of interceed and amniotic membrane graft in the prevention of postoperative adhesions in the rabbit uterine horn model. Eur J Obstet Gynecol Reprod Biol 1994; 55: 179-182.
Arruga H. Cirugía Ocular. Barcelona:Salvat 1950. pp 330-4.
Ashworth MF, Morton KE, Dewhurst J, et al. Vaginoplasty using amnion. Obstetr Gynecol 1986; 67: 443-446.
Avila M, Espana M, Moreno C, Peña C. Reconstruction of ocular surface with heterologous limbal epithelium and amniotic membrane in a rabbit model. Cornea 2001; 20: 414-420.
Azuara-Blanco A, Pillai CT, Sarhan A, Dua HS. Amniotic membrane transplantation for ocular surface reconstruction. Invest Ophthalmol Vis Sci 1998; 39: S428.
Azuara-Blanco A, Pillai CT, Dua HS. Amniotic membrane transplantation for ocular surface reconstruction. Br J Ophthalmol 1999; 83: 399-402.
Badawy SZA, Baggish MS, ElBakry MM, Baltoyannis P. Evaluation of tissue healing and adhesion formation after an intraabdominal amniotic membrane graft in the rat. J Reproductive Med 1989; 34: 198-202.
Balbi C, Balbi GC. Riepitelizzazione di ectropion con applicazione di una membrana amniotica a lunga conservazione. Minerva Ginecol 1989; 41: 145-148.
Barabino S, Rolando M, Bentivoglio G, et al. Role of amniotic membrane transplantation for conujunctival.





 contacto.spaelectronico@gmail.com
contacto.spaelectronico@gmail.com
 Mexico ( 52) 777 3 23 74 91 Whatsapp: ( 521)777 2 89 52 52
Mexico ( 52) 777 3 23 74 91 Whatsapp: ( 521)777 2 89 52 52